
Cambiamenti di stato in Fisica: fusione e solidificazione. Spiegazione, formule ed esempi

Indice
1Cambiamenti di stato in Fisica: premessa
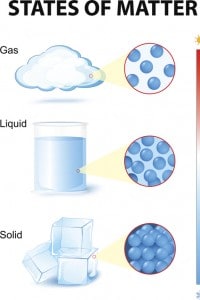
Come anticipato nella sezione “La costituzione della materia: composizione, struttura, stati di aggregazione e proprietà”, ogni sostanza può trovarsi – entro determinati range di temperatura e pressione – in uno dei tre stati di aggregazione, solido, liquido e gassoso, considerati anche come delle fasi di equilibrio. Con opportune variazioni di temperatura o pressione, la materia può passare da uno stato ad un altro attraverso un processo durante il quale le molecole modificano il proprio moto e le loro mutue distanze o moto e distanza contemporaneamente.
Per quanto non sia semplice dare una definizione rigorosa degli stati della materia, in generale possiamo affermare che:
- i solidi sono caratterizzati da forma e volumi propri, sono resistenti alle deformazioni e sono difficilmente comprimibili;
- i liquidi hanno un volume definito e la forma dipendente dal recipiente che li contiene;
- i gas occupano completamente il volume disponibile e sono facilmente comprimibili.
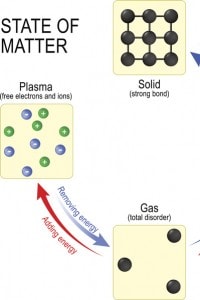
Ricordiamo inoltre che in aggiunta a queste tre fasi della materia c’è un quarto stato di aggregazione, chiamato plasma. Si tratta in pratica di un gas ionizzato che si ottiene fornendo alle molecole che lo costituiscono, una quantità di energia termica sufficiente a dissociare le molecole e ionizzare gli atomi. Tale stato può essere assimilato quindi ad una miscela di atomi neutri e di particelle ionizzate.
Inoltre è bene sapere anche che esiste una serie di sostanze che non è possibile classificare secondo il comune schema di aggregazione. Un esempio in tal senso è rappresentato dal vetro: comunemente viene classificato fra i solidi ma in realtà è un liquido caratterizzato da un attrito interno tra le molecole (viscosità) molto alto. Le sostanze amorfe, a differenza di quelle cristalline che fondono ad una precisa temperatura, passano dallo stato solido a quello liquido in un intervallo di temperatura più o meno ampio.
1.1Forze intermolecolari
Una qualsiasi sostanza, in generale, coesiste in equilibrio in più di uno stato di aggregazione simultaneamente come ad esempio l’acqua con il vapore acqueo. Le molecole di una sostanza che si trovano ad una certa temperatura sono in continuo movimento, indipendentemente da quale sia lo stato di aggregazione. Tali moti di agitazione termica sono connessi direttamente con la fase della sostanza. All’aumentare della temperatura aumenta la velocità media delle molecole e quindi la corrispondente energia cinetica. Questo implica la tendenza delle molecole a disperdersi allontanandosi le une dalle altre.
La forza di mutua interazione che agisce su piccola scala dipende principalmente dalla distanza tra le due molecole considerate. La forza attrattiva tra molecole prevale per distanza grandi rispetto alle dimensioni molecolari; la forza repulsiva inizia invece a manifestarsi quando la distanza tra le molecole tende a zero.
2Cambiamenti di stato
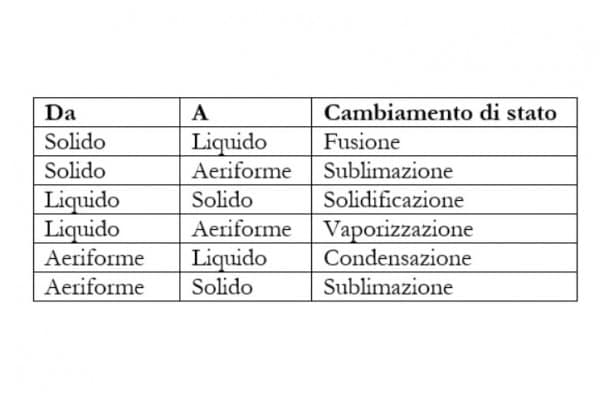
Le condizioni fisiche che caratterizzano la materia fanno sì che la stessa si presenti in un particolare stato di aggregazione. La materia può passare da uno stato di aggregazione all’altro in seguito ad opportune variazioni ad esempio di temperatura o pressione. In particolare questo succede attraverso un processo durante il quale le molecole modificano il proprio moto e/o la loro reciproca distanza. Tali processi vanno appunto sotto il nome di cambiamenti di stato o di fase e possono essere riassunti nel modo seguente:
Come abbiamo già visto, gli stati di aggregazione della materia sono determinati dal tipo di forze che ci sono tra le particelle che costituiscono la sostanza in esame. Tali forze possono essere modificate sottraendo o fornendo energia sotto forma di calore ed è in questo modo che si fa avvenire un cambiamento o passaggio di stato.
Nello specifico, possiamo sottolineare che i cambiamenti di stato che avvengono fornendo energia termica alla sostanza sono: fusione, vaporizzazione e sublimazione (da solido a aeriforme). Questi sono caratterizzati da un indebolimento delle forze intermolecolari e da un aumento della libertà di movimento delle particelle.
I cambiamenti inversi, quelli in cui è la sostanza che rilascia energia provocando un rafforzamento dei legami molecolari e una diminuzione della libertà di movimento delle particelle, sono: solidificazione, condensazione e sublimazione (da aeriforme a solido). Molti corpi possono presentarsi in ciascuno dei tre stati descritti, a seconda delle condizioni di temperatura e pressione considerati.

Nel caso di cambiamenti di stato fatti avvenire in recipienti chiusi in presenza della sola specie in esame, i dati sperimentali a riguardo vengono riassunti in quelli che sono noti come diagrammi di stato, caratteristici di ciascuna sostanza. Si tratta in pratica di diagrammi in cui vengono riportate le curve di equilibrio tra gli stati di aggregazione di un determinato sistema. Tali curve vengono costruite fornendo gradualmente al sistema piccole quantità di calore, aspettando che si arrivi all’equilibrio e registrando man mano i valori di pressione e temperatura.
I diagrammi di stato sono utili per mostrare le diverse fasi di una sostanza su un piano cartesiano (p.t): ad esempio, nel caso dell’acqua, il ghiaccio e il vapore ne rappresentano rispettivamente lo stato solido e quello aeriforme ed è possibile visualizzare sul relativo diagramma il cosiddetto punto triplo, quello in cui cioè possono coesistere in equilibrio stato solido, liquido e aeriforme (per l’acqua, il punto triplo è caratterizzato da una temperatura pari a 273,16 K).
2.1Fusione e solidificazione
Come anticipato, la fusione è il passaggio dallo stato solido allo stato liquido e la trasformazione inversa va invece sotto il nome di solidificazione.
Fornendo calore ad un oggetto solido, in un primo momento la sua temperatura aumenta, poi rimane costante per un certo periodo e contemporaneamente si verifica il fenomeno della fusione. Inizialmente, l’energia termica fornita viene utilizzata per aumentare l’energia cinetica media delle particelle, causando un aumento di temperatura della sostanza; una volta raggiunta la temperatura di fusione che caratterizza la sostanza, l’energia termica viene utilizzata per indebolire le forze intermolecolari: nella fusione si ha una piccola variazione delle distanze tra le componenti microscopiche della materia che comunque determina un notevole indebolimento delle forze intermolecolari. Per questo dunque le molecole e gli atomi presentano una maggiore libertà di movimento che va ad alterare la configurazione cristallina.
La temperatura rimane costante per un certo periodo. Per far cambiare di stato tutta la sostanza, è necessario fornire una quantità di calore ben determinata. Ricordiamo quindi che:
- la fusione di una sostanza, ad una data pressione, avviene ad una determinata temperatura (temperatura di fusione Tf di quella sostanza);
- nell’intervallo di tempo in cui avviene la fusione di una sostanza, la sua temperatura si mantiene costante;
- se una massa m di una data sostanza allo stato solido si trova già alla temperatura di fusione, l’energia necessaria per fonderla completamente è direttamente proporzionale ad m.
(ΔE = cf. m dove cf indica il calore latente di fusione, a cui è dedicato il paragrafo successivo e definibile come la quantità di energia necessaria per fondere completamente 1 kg di una data sostanza).
Nella solidificazione invece, con la diminuzione della temperatura, si ha una diminuzione dell’energia interna delle unità costituenti la materia.
La temperatura di solidificazione di una sostanza corrisponde alla sua temperatura di fusione: la quantità di energia che l’ambiente spende per fondere una certa quantità di sostanza deve essere uguale a quella che guadagna quando questa solidifica. Secondo la conservazione dell’energia, durante la solidificazione la sostanza considerata cede all’ambiente una quantità di energia ricavabile con la seguente formula: ΔE = - cf. m (calore latente di solidificazione è uguale in valore assoluto al calore latente di fusione).
Durante la solidificazione si ha una limitazione nel movimento delle molecole e degli atomi che si riduce infine ad un movimento periodico e vibrazionale attorno ad alcuni centri di equilibrio. Poiché già nel liquido le molecole erano addensate, si assiste in questo caso ad una piccola variazione nel volume. Le particelle della sostanza si legano fra loro e si dispongono in strutture cristalline regolari. Quando la sostanza liquida si è completamente solidificata, la temperatura riprende a scendere.
3Calore latente
In generale, bisogna sottolineare che la coesistenza della fase solida e della fase liquida di una sostanza (equilibrio), si può riscontrare solo a una data temperatura e per uno specifico valore di pressione, entrambi dipendenti dalla sostanza considerata. Inoltre, poiché durante la fusione la temperatura rimane costante, il calore fornito viene utilizzato per l’indebolimento delle forze intermolecolari per disgregare cioè la struttura ordinata caratteristica dello stato solido.
Il calore latente di fusione è una grandezza caratteristica di ogni sostanza chimicamente definita e che esprime quantitativamente l’apporto energetico necessario per produrre la fusione. Tale grandezza può infatti essere definita come la quantità di calore che è necessario fornire, a pressione costante, alla massa unitaria di un solido, portato alla temperatura di fusione, per ottenerne il passaggio completo allo stato liquido ma senza alterare la temperatura.
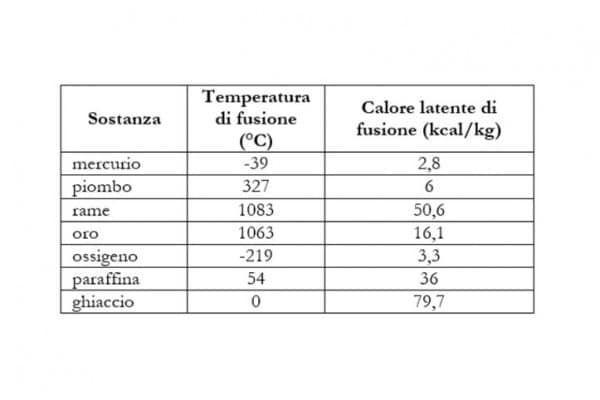
Analogamente, il calore latente di solidificazione indica la quantità di calore che l’unità di massa di un liquido alla temperatura di solidificazione cede all’ambiente. A titolo di esempio, vengono riportati di seguito i valori di temperatura di fusione e di calore latente per alcune sostanze:
3.1Il fenomeno del rigelo
Abbiamo già evidenziato che la temperatura di fusione e quella di solidificazione variano con la pressione. Una conseguenza di ciò è rappresentata dal fenomeno del rigelo. Ad esempio, considerando un blocco di ghiaccio posto su due sostegni e un filo metallico con agli estremi due corpi grossi posto a cavallo sul blocco. La pressione esercitata dal filo fa fondere il ghiaccio e il filo in questo modo riesce ad attraversarlo. Il blocco però non si spezza poiché l’acqua sfugge alla compressione e passa al di sopra del filo solidificando poiché viene a trovarsi a 0 °C.
4Esempio della fusione del piombo

Considerando i cambiamenti di stato indotti dalle variazioni di temperatura, possiamo considerare alcuni esempi. Se poniamo dei pezzetti di piombo in un crogiolo riscaldato da una sorgente di calore, e controllando la temperatura con apposito strumento, noteremo che alla pressione di 1 atm, quando viene raggiunta la temperatura di 327 °C questa si mantiene costante e il piombo inizia a fondere. Tale temperatura rimane costante finché la fase solida del piombo coesiste con quella liquida.
Quando tutto il piombo è passato allo stato liquido, la temperatura inizia nuovamente ad aumentare. Se lasciamo raffreddare il sistema, la temperatura diminuisce fino al punto di fusione, in corrispondenza del quale il piombo liquido inizia a solidificare. Per tutto il periodo di tempo in cui coesistono la fase solida e quella liquida, la temperatura rimane bloccata a 327 °C.
Quando tutto il piombo è passato allo stato solido, cedendo all’ambiente esterno la stessa quantità di calore assorbita durante la fusione, la temperatura riprende a diminuire finché il sistema non raggiunge uno stato di equilibrio termico con l’ambiente.
I risultati sperimentali dimostrano quindi che:
- a una determinata pressione, ogni sostanza cristallina presenta una temperatura di fusione caratteristica e che coincide con la temperatura di solidificazione;
- la temperatura rimane costante durante la fusione e durante la solidificazione;
- la temperatura di fusione varia con la pressione: un aumento di pressione determina un innalzamento della temperatura di fusione per le sostanze che fondendo aumentano di volume; una riduzione di pressione determina invece un abbassamento della temperatura di fusione per le sostanze che fondendo diminuiscono di volume.
 Fisica
Fisica