Numero di ossidazione
Il numero di ossidazione indica la carica formale di un atomo in un composto, ipotizzando che tutti i legami chimici siano legami ionici.
Detto in pratica, il numero di ossidazione è il numero di elettroni di valenza che rimane a un atomo, dopo aver assegnato gli elettroni di legame all'atomo più elettronegativo della coppia di legame.
Il numero di ossidazione è un numero intero
- positivo se in un legame l'atomo cede elettroni
- negativo se in un legame l'atomo acquista elettroni
- nullo se l'atomo non cede, né acquista elettroni
Esempio. Se l'atomo cede elettroni, la sua carica positiva nucleare prevale su quella negativa degli elettroni. Quindi l'atomo assume carica formale positiva. Viveversa, se l'atomo acquista elettroni, l'atomo assume carica formale negativa. Infine, se l'atomo neutro non cede o acquista elettroni e la sua carica formale è nulla.
L'acquisto di elettroni (riduzione del n.o.) si chiama riduzione.
La cessione di elettroni (aumento del n.o.) si chiama ossidazione.
Nota. Ovviamente, la riduzione e l'ossidazione sono fenomeni speculari che avvengono nello stesso tempo ma in atomi diversi del legame. Il numero di elettroni acquisiti e ceduti è lo stesso.
Va comunque ricordato che non si tratta di una reale cessione o acquisto di elettroni. Questo accade solo nei composti ionici.
Nel calcolo del numero di ossidazione considero i legami covalenti come se fossero legami ionici. In realtà... non lo sono.
Quanti numeri di ossidazione ha un elemento chimico?
Alcuni elementi hanno un solo numero di ossidazione fisso (es. metalli alcalini e alcalino-terrosi) mentre altri hanno più numeri di ossidazione a seconda dei composti in cui è presente.
Nota. Il calcolo del numero di ossidazione si effettua solo se l'atomo appartiene a un composto. Il numero di ossidazione di qualsiasi atomo neutro isolato (non legato) è sempre zero. Nel caso di uno ione semplice (isolato), invece, il numero di ossidazione coincide con la carica elettrica dello ione.
Come calcolare il numero di ossidazione
Metodo 1
Per calcolare il numero di ossidazione di un atomo in un composto seguo questi passaggi
- Conto gli elettroni di valenza (EV) in ogni atomo del composto.
- Ipotizzo che i legami di un composto siano tutti legami ionici anche se non lo sono.
Perché? In un legame ionico gli atomi cedono o acquistano gli elettroni in modo permanente, mentre in un legame covalente sono soltanto condivisi. Quindi, ipotizzando che siano tutti legami ionici posso lavorare con dei numeri interi.
- In ogni singolo legame chimico del composto, assegno gli elettroni della coppia di legame all'atomo più elettronegativo.
- Conto gli elettroni di legame (EL) in ogni atomo del composto, considerando gli elettroni liberi e quelli assegnati in base all'elettronegatività.
- Il numero di ossidazione di ogni atomo del composto è pari alla differenza tra il numero gli elettroni di valenza (EV) e gli elettroni di legame (EL). $$ NO = EV-EL $$
Metodo 2
Se conosco la formula di struttura della molecola
- Assegno -1 all'atomo più elettronegativo di ogni doppietto di legame
- Assegno +1 all'atomo meno elettronegativo di ogni doppietto di legame
- Non scrivo nulla se gli atomi del doppietto di legame hanno la stessa elettronegatività.
- Se un atomo ha più legami sommo algebricamente i valori tra loro.
In questo modo ottengo i numeri di ossidazione degli atomo del composto.
Esempio. Una molecola di etanolo (C2H6O) è composta da due atomi di carbonio, sei atomi di idrogeno e un atomo di ossigeno. La formula bruta è la seguente.
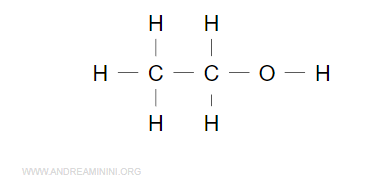
Sapendo che i valori di elettronegatività degli atomo sono 2.22 (idrogeno), 2.55 (carbonio), 3.44 (ossigeno), assegno il doppietto di legame all'atomo più elettronegativo della coppia.
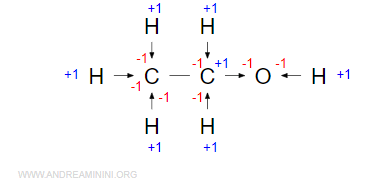
Da notare che il doppietto elettronico C-C non lo considero perché gli atomi hanno la stessa elettronegatività. A questo punto, sommo algebricamente i valori interi in ogni atomo e ottengo i numeri di ossidazione degli elementi.
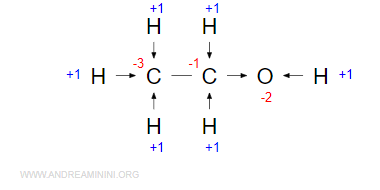
Ho scritto in rosso le riduzioni e in blu le ossidazioni. Come si può notare, la somma dei numeri di ossidazione è nulla perché la molecola è neutra.
Questo metodo è molto più semplice e rapido del precedente.
Tuttavia, se non conosco la struttura del composto, è meglio usare un altro metodo. Ad esempio, il metodo delle regole.
Metodo 3 (metodo delle regole)
Applicando queste regole posso calcolare rapidamente il numero di ossidazione degli atomi di un composto anche se non conosco la sua formula di struttura.
- Un atomo isolato di qualsiasi elemento chimico ha sempre il numero di ossidazione nullo.
Esempio. L'atomo di idrogeno (H) e di ossigeno (O) quando non fanno parte di un composto hanno n.o.=0. Lo stesso vale per tutti gli elementi chimici.
- Una molecola allo stato elementare, ossia con tutti gli atomi uguali, ha numero di ossidazione nullo.
Esempio. In una molecola di ossigeno O2 il n.o. dell'ossigeno è zero (n.o.=0). Lo stesso accade in una molecola di ozono O3 e in qualsiasi altra molecola composta da atomi dello stesso elemento chimico (es. H2, F2, N2, ecc. ).
- In una molecola neutra la somma dei numeri di ossidazione degli atomi è nulla.
Esempio. La molecola di acqua H2O è composta da due atomi di idrogeno e un atomo di ossigeno. Nei composti l'idrogeno ha numero di ossidazione +1 mentre l'ossigeno -2. Essendo una molecola neutra, priva di carica, la somma algebrica dei numeri di ossidazione di tutti gli atomi del composto è nulla. $$ 2H + O = 2(+1)+(-2) = 2 - 2 = 0 $$
- In una reazione chimica la somma dei numeri di ossidazione degli atomi è nulla.
Esempio. Una molecola d'acqua è composta da due atomi di idrogeno e un atomo di ossigeno. $$ 2H + O \rightarrow = 2 \cdot (+1) + 1 \cdot (-2) = 0 $$
- L'idrogeno (H) ha numero di ossidazione +1 se è legato ad atomi più elettronegativi, -1 se è legato ad atomi meno elettronegativi (es. metalli), nullo se è legato con altri atomi di idrogeno.
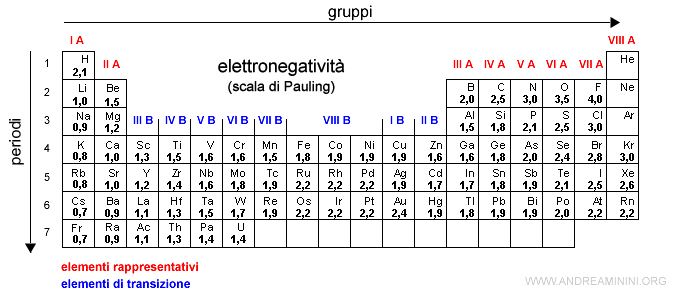
Esempio. Nell'acqua H2O l'idrogeno ha n.o.=+1 mentre nell'idruro di sodio NaH ha n.o.=-1. La molecola di idrogeno H2 ha, invece, n.o.=0.
- L'ossigeno (O) ha numero di ossidazione -2 in tutti i suoi composti ossidi, tranne nei perossidi (es. H2O2) dove ha -1 e nei superossidi (es. NaO2) dove ha n.o.=-1/2.
Esempio. Nell'acqua H2O l'ossigeno n.o.=-2 mentre nell'acqua ossigenata H2O2 il numero di ossidazione è n.o.=-1. La molecola di ozono O3 o di ossigeno O2 hanno, invece, n.o.=0. Fa eccezione alla regola soltanto la molecola OF2 dove l'ossigeno ha n.o.=+2 perché il fluoro è l'elemento più elettronegativo (3.98) della tavola periodica seguito dall'ossigeno (3.44).
- Il fluoro (F) ha sempre un numero di ossidazione n.o.=-1 in ogni composto perché ha il valore di elettronegatività (3.98) più alto degli elementi chimici. L'unica eccezione è la molecola di fluoro F2 dove il numero di ossidazione è nullo (n.o.=0).
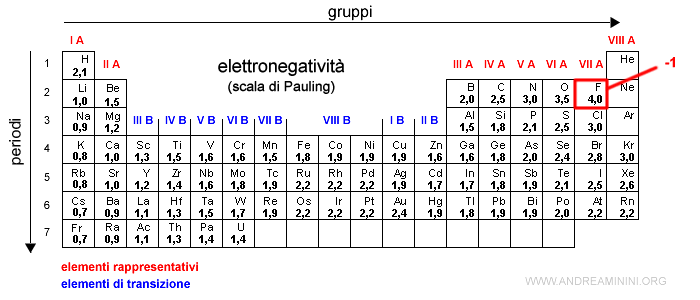
- I metalli alcalini (gruppo I) hanno sempre un numero di ossidazione pari a +1 nei composti.
- I metalli alcalino terrosi (gruppo II), lo zinco (Zn) e il cadmio (Cd) hanno sempre un numero di ossidazione +2 nei composti.
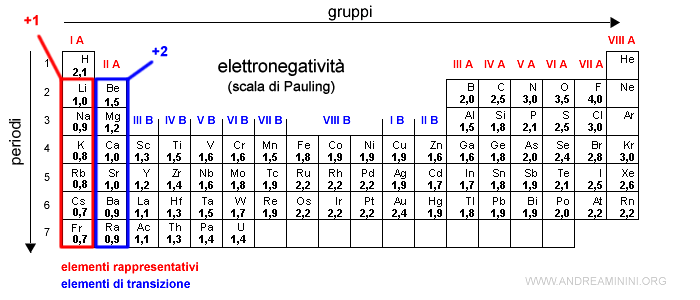
- Uno ione semplice isolato (monoatomico) ha il numero di ossidazioni pari alla carica dello ione.
Esempio. Il numero di ossidazione dello ione negativo Cl- è -1 come la sua carica.
- In uno ione poliatomico la somma dei numeri di ossidazione coincide con la carica dello ione.
Esempio. La somma dei n.o. dello ione poliatomico SO42- è -2.
Applicando queste regole posso calcolare il numero di ossidazione degli atomi del composto molto rapidamente.
Esempio. La molecola di etanolo (C2H6O) è composta da due atomi di carbonio, sei atomi di idrogeno e un atomo di ossigeno. $$ 2C + 6H + O \rightarrow C_2H_6O $$ La molecola è neutra, quindi la somma dei numeri di ossidazione è nulla. Sapendo che il n.o. dell'idrogeno è +1 mentre quello dell'ossigeno è -2, assegno l'incognita x al numero di ossidazione del carbonio e scrivo l'equazione seguente $$ 2 C + 6 H + O = 0 $$ $$ 2x + 6 (+1) + (-2) = 0 $$ $$ 2x + 4 = 0 $$ $$ x = \frac{-4}{2} = -2 $$ Il numero di ossidazione del carbonio nel composto C2H6O è -2. In effetti, guardando la formula gli atomi del carbonio hanno due numeri di ossidazione -3 e -1, la cui media aritmetica è -2. Il risultato è lo stesso.

Un esempio pratico
Esempio 1
La molecola d'acqua H2O è composta da due atomi di idrogeno e un atomo di ossigeno.
$$ 2H + O \rightarrow H_2O $$
La configurazione superficiale dell'idrogeno è 1s mentre quella dell'ossigeno è 2s 4p.
Quindi, l'idrogeno ha un elettrone di valenza e l'ossigeno ha sei elettroni di valenza.
$$ EV_H= 1 $$
$$ EV_O=6 $$
Si formano due legami chimici O-H che permettono all'ossigeno di completare l'ottetto e agli atomi di idrogeno il duetto.
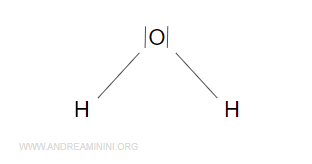
L'elettronegatività dell'ossigeno è 3.4 mentre quella dell'idrogeno è solo 2.2.
Quindi, assegno le coppie di elettroni dei legami covalenti all'ossigeno perché più elettronegativo dell'idrogeno.
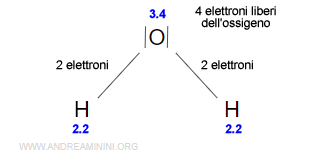
Dopo la modifica l'ossigeno ha otto elettroni di legame perché acquisisce i due elettroni dei due atomi di idrogeno.
Gli atomi di idrogeno, invece, hanno zero elettroni di legame perché perdono l'elettrone.
$$ EL_H= 0 $$
$$ EL_O=4+2+2=8 $$
Nota. Si tratta solo di un calcolo matematico utile per calcolare il numero di ossidazione. Nella realtà, nei legami covalenti gli atomi non perdono gli elettroni perché sono condivisi.
Per calcolare il numero di ossidazione degli atomi calcolo la differenza tra gli elettroni di legame e gli elettroni di valenza.
L'atomo di ossigeno ha 8 elettroni di legame e 6 elettroni di valenza. Quindi, il suo numero di ossidazione è -2.
$$ NO_O = EV_O - EL_O = 6-8 = -2 $$
Ogni atomo di idrogeno ha 0 elettroni di legame e 1 elettrone di valenza. Quindi, il numero di ossidazione di ogni atomo H è +1.
$$ NO_H = EV_H - EL_O = 1-0 = +1 $$
Ho trovato il numero di ossidazione dell'idrogeno (+1) e dell'ossigeno (-2).
Nota. Il numero di ossidazione dell'ossigeno (-2) indica la carica negativa dell'atomo di ossigeno che acquisisce due elettroni dai due legami. Il numero di ossidazione di un atomo di idrogeno (+1) indica la carica positiva dell'atomo di idrogeno che perde un elettrone nel legame con l'ossigeno.
Per una verifica sommo i numeri di ossidazione degli atomi dell'acqua.
$$ 2H + O = 2(+1) + (-2) = 0 $$
La somma algebrica è nulla perché il composto è neutro.
Esempio 2
L'esempio precedente posso risolverlo anche in questo modo.
Sapendo che l'ossigeno è più elettronegativo dell'idrogeno

Assegno il primo legame e il secondo legame all'atomo di ossigeno.
Quindi, scrivo -1 due volte sull'atomo di ossigeno e +1 sugli atomi di idrogeno.
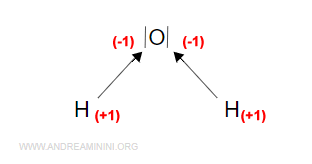
Poi sommo algebricamente i valori e ottengo i numeri di ossidazione dell'ossigeno e dell'idrogeno.
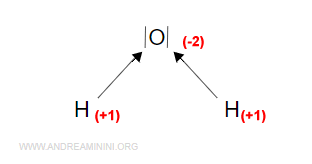
Il risultato è sempre lo stesso.
Nella molecola d'acqua l'ossigeno ha un numero di ossidazione pari -2 mentre gli atomi di idrogeno hanno un numero di ossidazione pari a +1.
Esempio 3
La molecola di acido solforico è
$$ H_2SO_4 $$
Calcolo i numeri di ossidazione applicando il metodo delle regole.
Dalle regole so già che il numero di ossidazione dell'idrogeno è +1 e quello dell'ossigeno è -2.
La molecola è neutra, quindi la somma dei numeri di ossidazione deve essere pari a zero.
A questo punto scrivo un'equazione con i dati appena ottenuti
$$ 2 \cdot H+S+4 \cdot O=0 $$
Sostituisco ai simboli dell'idrogeno (H) e dell'ossigeno (O) i rispettivi numeri di ossidazione
$$ 2(+1)+S+4(-2) = 0 $$
$$ 2+S-8 = 0 $$
Quindi, metto in evidenza l'atomo di zolfo (S) e ottengo il numero di ossidazione dello zolfo.
$$ S = 8-2 $$
$$ S = +6 $$
In questo modo ho calcolato tutti i numeri di ossidazione senza alcuna informazione sulla struttura della molecola.
La differenza tra valenza e numero di ossidazione
La valenza e il numero di ossidazione sono concetti diversi
- La valenza è il numero di legami che un atomo forma con gli atomi di idrogeno in un composto.
Nota. Più in generale la valenza di un atomo è il numero degli elettroni negli orbitali più esterni contando solo gli orbitali s e p. Quindi, la valenza è un numero compreso tra 1 a 8. Nella tavola periodica corrisponde al numero del gruppo.
- Il numero di ossidazione è la carica formale di un atomo legato supponendo per ipotesi che tutti i legami siano legami ionici.
In passato la valenza era usata per indicare la capacità di un elemento chimico di reagire formando dei composti.
Successivamente si è preferito usare il concetto di numero di ossidazione perché è più vicino alla struttura elettronica dell'elemento chimico.
Nota. Nei composti ionici la valenza di un atomo coincide con l'elettrovalenza, perché un legame ionico implica il trasferimento permanente di un elettrone di valenza da un atomo all'altro. Quindi, in un composto ionico il numero di elettroni acquisiti o ceduti dagli atomi corrisponde rispettivamente al numero delle cariche elettriche negative o positive acquisite o cedute. Nei composti molecolari, invece, gli atomi sono legati da legami covalenti e gli elettroni sono condivisi da entrambi gli atomi legati. In questo caso la valenza non corrisponde esattamente alle variazioni delle cariche elettriche positive o negative, ossia della carica formale degli atomi. Per questa ragione, nella comunità scientifica è stato introdotto il concetto di numero di ossidazione.
E così via.
